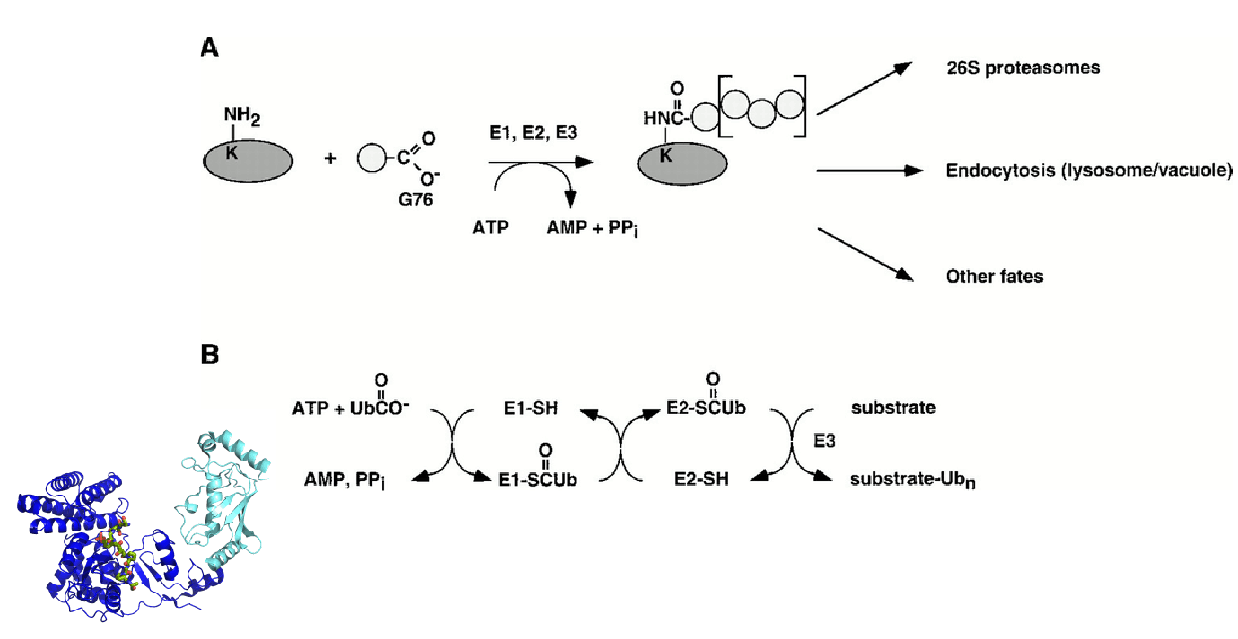
泛素蛋白酶体途径是目前己知的所有真核生物体内具有高度选择性的最为重要的蛋白质降解途径。真核细胞中泛素化修饰后的靶蛋白可能被降解、可能被转移到细胞或细胞外的特定部位,也有可能导致靶蛋白的功能发生变化。 泛素化修饰(Ubiquitination)涉及泛素激活酶E1、结合酶E2和泛素连接酶E3的一系列反应。特异的E3连接酶参与底物的识别,和决定底物单泛素化或多聚泛素化修饰,因此对其底物的鉴定显得尤为重要。
E3连接酶靶蛋白通过泛素化途径参与到细胞周期调控、胞吞作用、信号转导、DNA修复、蛋白质的质量控制(例如Bsd2在膜蛋白的质量控制方面具有重要作用)、细胞凋亡、应激等过程具有重要的作用。